FLujo de gas en un destilador multicomponente
Problema
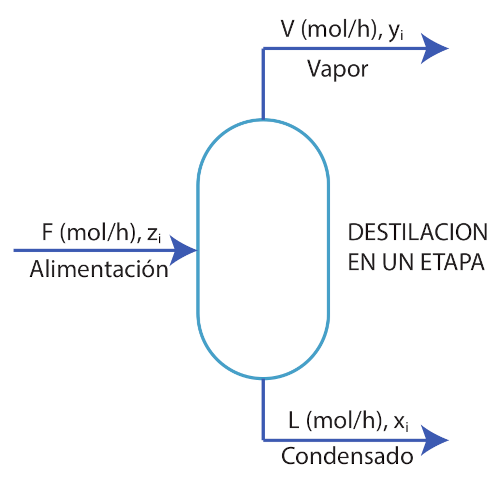
Usando los datos de la tabla de composiciones para un gas natural a $P = 11\space MPa\space$ y $\space T = 48 °C$. Resuelva para el flujo $V(mol/h)$ usando las ecuaciones de equilibrio, sabiendo que se tiene flujo molar de entrada $F = 100 mol/h$.
$$ \begin{array}{c|c|c|c} Componente & i & z_{i} & k_{i} & \ \hline metano & 1 & 0.8345 & 3.090 &\ dioxido de carbono & 2 & 0.0046 & 1.650 &\ etano & 3 & 0.0381 & 0.720 &\ propano & 4 & 0.0163 & 0.390 &\ i-butano & 5 & 0.0050 & 0.210 &\ n-butano & 6 & 0.0074 & 0.175 &\ pentanos & 7 & 0.0287 & 0.093 &\ hexanos & 8 & 0.0220 & 0.065 &\ heptanos + & 9 & 0.0050 & 0.210 &\ \end{array} $$
Fuente: Geankoplis, C. J. (1993) Transport Processes and Unit Operations
Planteando las ecuaciones del balance másico:
$$ \begin{array}{l} F&=, L + V \ z_{i}F &=, x_{i}L + y_{i}V \end{array} $$
Condiciones de equilibrio: $\space\space y_{i}=k_{i}x_{i}\space\space$; $\space\space\space\sum x_{i}=\sum y_{i}=1$
Combinando estas ecuaciones podemos obtener:
$$\sum_{i=1}^{n} \frac {z_{i}F}{V(k_{i}-1)+F}=1$$
Reordenando nuestra ecuación igualandola a cero:
$$foo(V)=\sum_{i=1}^{n} \frac {z_{i}F}{V(k_{i}-1)+F}-1=0$$
Nótese que para el valor correcto de $V$ nuestra función $foo(V)=0$
1# Definimos la función foo
2def foo(V):
3 F = 100
4 z = [
5 0.8345,
6 0.0046,
7 0.0381,
8 0.0163,
9 0.0050,
10 0.0074,
11 0.0287,
12 0.0220,
13 0.0434
14 ]
15
16 k = [3.090,
17 1.650,
18 0.720,
19 0.390,
20 0.210,
21 0.175,
22 0.093,
23 0.065,
24 0.036
25 ]
26
27 n = len(z)
28 f = sum([z[i] * F / (V * (k[i] - 1) + F) for i in range(n)])
29 return f - 1
30
31
32# Definimos la función que va resolver el problema
33def equilibrio_LV():
34 a, b = 100, 80
35 c = b - foo(b) * (b - a) / (foo(b) - foo(a))
36 while abs(foo(c)) > 1e-4:
37 a, b = b, c
38 c = b - foo(b) * (b - a) / (foo(b) - foo(a))
39 return c
40
41
42print(equilibrio_LV())
43# Resultado 88.66942481438184
Nuestro resultado es $88.6694 \space mol/h$